De Amy Berger http://www.tuitnutrition.com/2015/09/its-the-insulin-2.html
Traducido por Alejandra Ruiz
Si pasó por las publicaciones enciclopédicas que fueron la parte 1 y la parte 2 de esta serie sobre insulina y ha vuelto por más, ¡gracias! Es uno de mis mayores defectos como escritora: la brevedad no es mi fuerte. (Pero al menos admito que tengo un problema. Ese es el primer paso, ¿verdad?).
Esta publicación no es una excepción. De hecho, probablemente sea más larga que la primera. Así que ve a tomar una taza de té o lo que quieras, y agárrate para una lectura larga y agradable.
La última vez señalé que, al abarcar los efectos de los niveles elevados de insulina y glucosa en el sistema cardiovascular, la función reproductiva, el cerebro, los riñones, los ojos, el oído interno y los mecanismos de equilibrio, no había dicho nada sobre la obesidad. Espero que estemos todos en la misma página y podamos estar de acuerdo en que la resistencia a la insulina no es algo que se limite a las personas que llevan unos pocos, o un par de cientos de kilos de más. Obviamente, hay millones de personas sin sobrepeso que son infértiles, tienen enfermedades cardíacas, enfermedades renales, problemas de visión, demencia y más. (Ya escribí sobre esto antes. Una de mis publicaciones favoritas en todo este blog es en la que expliqué que la obesidad es simplemente un efecto más del trastorno metabólico, en lugar de su causa. También escribí sobre este tema para Designs for Health).
No obstante, nos perderíamos una pieza importante del rompecabezas de la insulina si no habláramos del papel de la insulina en la regulación del peso corporal. Sin embargo, antes de llegar a eso, primero debemos observar las funciones reales de la insulina, así como del páncreas. Es un subproducto desafortunado de nuestra epidemia de «diabesidad» que automáticamente pensamos en la glucosa en sangre cuando escuchamos la palabra insulina. Y no hay duda de que la insulina tiene un papel importante en la regulación o, específicamente, en la reducción de la glucosa en sangre (GS). Pero esa no es la única función de la insulina. De hecho, diría que ni siquiera es la función principal. Llegaremos al peso, lo prometo. Pero al igual que hicimos en la serie sobre el cáncer, tenemos que atravesar muchas malezas bioquímicas antes de llegar a lo bueno. Así que aquí va.
Es hora de una breve lección de endocrinología extremadamente detallada.
Acciones fisiológicas de la insulina y Hormonas contrarreguladoras de la insulina
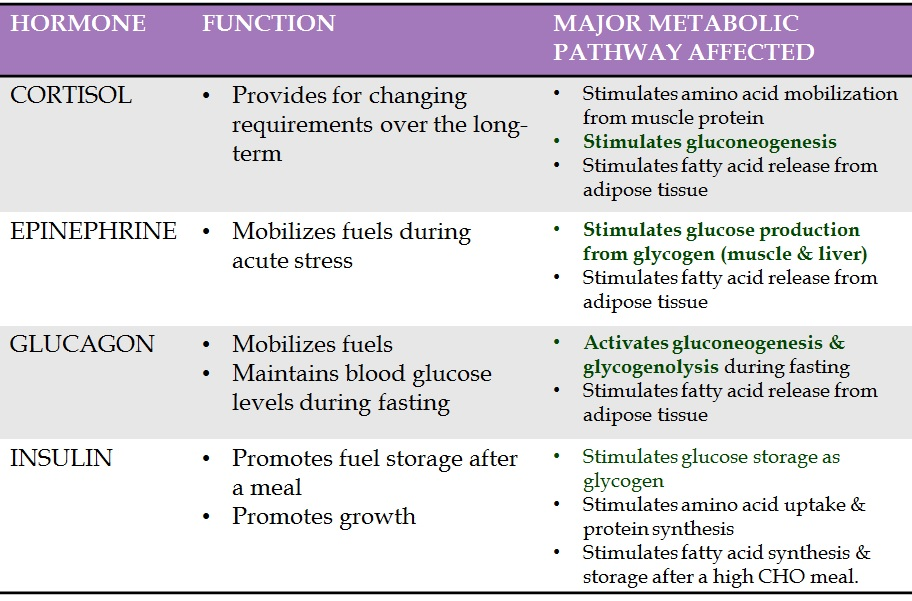
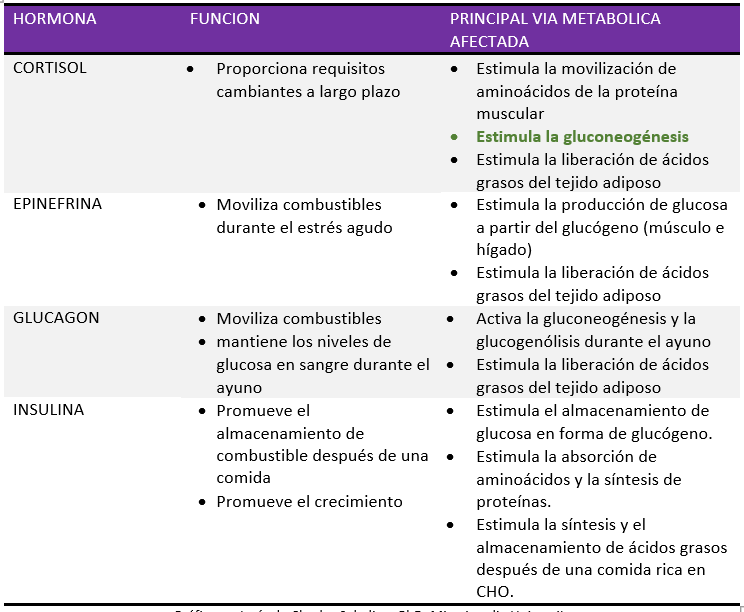
Como puedes ver, hay tres hormonas – TRES – cuya función es aumentar la glucosa en sangre (GS), y solo una – UNA – cuya función es reducirla. De buenas a primeras, esto insinúa algo: el cuerpo humano puede haber sido condicionado en un entorno en el que probablemente había una necesidad frecuente y/o inmediata y crucial de aumentar la glucemia, y una necesidad mucho menor de reducirla. Esto sugiere que nuestra glucemia no estaba tan alta y con tanta frecuencia, considerando que hay una redundancia triplicada en los mecanismos para aumentarla, pero solo un punto único de falla para reducirla. (Es decir, hablando hormonalmente. Sin olvidar la eliminación de glucosa no mediada por insulina, que es un buen beneficio del ejercicio intenso).
No estoy afirmando que la perspectiva de la salud evolutiva/ancestral sea correcta el 100% de las veces, ni que sea lo único que debamos considerar cuando intentamos darle sentido a las cosas. Creo, sin embargo, que proporciona un marco útil para guiarnos en la evaluación de las cosas de manera lógica e inteligente, y que podemos buscar en el registro antropológico para tratar de encontrar respuestas a algunos de nuestros males modernos. Por ejemplo: nuestras dietas ancestrales eran probablemente mucho menos insulinogénicas que la moderna, rica en granos. Incluso si el hombre del Paleolítico, o quien quieras recordar como tus antepasados dietéticos etnogeográficos individuales, comía una pequeña cantidad de granos además de un suministro generoso de tubérculos y frutas de temporada; en general, la carga glucémica y los efectos de aumento de la insulina de la dieta total fueron probablemente muy pequeñas. Y estos antepasados homínidos pueden haber tenido la necesidad, no constantemente, pero con suficiente frecuencia, de huir de los depredadores o perseguir a sus presas, lo que habría necesitado una forma inmediata de elevar la glucosa en sangre. Y debido a que el aumento de GS en un momento crítico habría sido literalmente una cuestión de vida o muerte tiene sentido que la triple redundancia esté ahí. Es solo en el mundo moderno, donde el cortisol y la adrenalina (epinefrina) son altos todo el tiempo en algunas personas, donde esta inundación constante de glucosa en la sangre nos mete en problemas, particularmente cuando se combinan con una dieta alta en carbohidratos. En el pasado, aumentar la glucemia en el momento adecuado salvaba vidas. Hoy, sin embargo, mantener la glucemia (e insulina) alta todo el tiempo nos está matando literalmente.
Bien, entonces hay tres hormonas que aumentan la glucemia, mientras que la insulina la reduce. Y el efecto hipoglucemiante de la insulina es bastante importante. Pregúntele a un diabético tipo 1 si la insulina es «tóxica» y probablemente obtendrá una respuesta muy diferente a la de un nutricionista en el campo de la dieta baja en carbohidratos y cetogénica. La insulina no es tóxica. Es una hormona muy útil, cuando tu cuerpo responde correctamente. De hecho, la insulina, en sí misma, es una hormona que salva vidas. El desarrollo de insulina sintética para ayudar a los diabéticos tipo 1 fue un milagro. Las personas que estaban al borde de la muerte ahora podían llevar una vida larga, saludable y productiva. Definitivamente, una dieta baja en carbohidratos tiene un papel para los diabéticos tipo 1, pero incluso aquellos que siguen una dieta baja en carbohidratos seguirán necesitando algo de insulina. (Sólo dosis mucho, mucho más bajas de las que normalmente necesitan en una dieta alta en CHO).
Debido a que las inyecciones de insulina salvaron la vida de los diabéticos T1, podemos perdonar a los primeros pioneros en el tratamiento de la diabetes por suponer que serían igualmente beneficiosos para los diabéticos T2. Después de todo, si la insulina reduce la glucosa en sangre en los diabéticos T1 y los diabéticos T2 tienen una glucemia alta, entonces es lógico que la insulina ayude a los diabéticos T2 tanto como a los T1. Problema resuelto, enfermedad curada, ¿verdad?
Desafortunadamente, como sabemos ahora, el uso terapéutico de insulina para la diabetes tipo 1 no es lo mismo para la diabetes tipo 2.
Lo que los endocrinólogos convencionales no parecen darse cuenta es que la glucemia está elevada en los diabéticos T1 y en los diabéticos T2 por razones completamente diferentes. En las personas con diabetes Tipo 1, se debe a que producen poca o ninguna insulina. Por el contrario, los DT2 producen mucha insulina. Están inundados en insulina. Sus celdas prácticamente se están ahogando en ella. El problema es que sus células han dejado de responder correctamente. Es como la historia del niño que gritó lobo: hazlo una y otra vez y, finalmente, los aldeanos dejan de prestar atención. En la diabetes tipo 2, la insulina llama a la puerta, pero no hay nadie en casa. DT1 es deficiente de insulina, mientras que DT2 es resistente a la insulina frente al exceso de ella. (Puede llegar un momento en el que alguien tenga una diabetes tipo 2 muy avanzada y de larga duración, en el que sus células beta pancreáticas dejen de producir y no produzcan mucha insulina. Esto se denomina «agotamiento de las células beta». Obviamente, ese no es el escenario en el que nos estamos enfocando aquí. Solo quiero reconocer que puede suceder. Además, aún no se ha determinado si la hiperinsulinemia crónica causa resistencia a la insulina o si las células se vuelven resistentes a la insulina primero, lo que resulta en hiperinsulinemia. ¿Qué viene primero, el huevo o la gallina?)
Otra pista de que la diabetes tipo 1 y la diabetes tipo 2 son patologías diferentes es que un diabético T1 no tratado tendrá niveles elevados de glucosa en sangre junto con cetonas altísimas. (Las cetonas elevadas son el resultado del catabolismo descontrolado de su tejido adiposo. Esto es cetoacidosis, que es un estado completamente diferente de la cetosis nutricional inducida por la dieta). Los diabéticos T2, por otro lado, tendrán glucosa en sangre muy alta sin cetonas altísimas. ¿Por qué? Porque producen toneladas de insulina y la insulina inhibe la lipólisis. Digámoslo de nuevo: la insulina inhibe la lipólisis. (Siendo la lipólisis la principal fuente de cetonas). Volveremos a esto la próxima vez, cuando hablemos de la regulación de la grasa corporal. Los diabéticos T2 pueden experimentar cetoacidosis, pero es mucho más común en los T1.
Dar insulina a un diabético tipo 2 que ya segrega demasiada insulina es como recetar antiácidos erróneamente a personas que tienen poco ácido en el estómago. Si los médicos midieran la actividad del HCl (ácido clorhídrico) de los pacientes que se quejan de ERGE (Enfermedad por reflujo gastroesofágico), acidez estomacal e indigestión general, verían que la mayoría de estas personas no tienen exceso de ácido estomacal; ¡en realidad tienen muy poco! Y si los médicos midieran los niveles de insulina de un diabético T2, como lo hizo el Dr. Kraft con tantos pacientes, verían que tienen demasiada. Y, al seguir el llamado cuidado estándar, tendrían que reconciliar la sabiduría de darles a estas personas aún más insulina. Quizás hacer que el análisis de insulina sea parte de un chequeo regular finalmente despertaría a la medicina moderna a la idea de que la diabetes tipo 2 no es una deficiencia de insulina.
El páncreas: Endo, exo y paracrino
Ahora que hemos entrado en el territorio de la lipólisis y la cetosis, es hora de profundizar un poco más en los mecanismos fisiológicos de la insulina y otras hormonas reguladoras de la glucosa en sangre, así como de observar más de cerca el páncreas.
Con toda esta charla sobre la glucosa en sangre, sería fácil pensar que tu páncreas tiene una función, y una única función: secretar insulina. Por el contrario, esta es solo una de las muchas funciones que realiza este precioso órgano. El páncreas es un órgano endocrino, exocrino y paracrino. Como órgano endocrino, secreta hormonas a la sangre. Como órgano exocrino, secreta sustancias en un conducto. Como órgano paracrino, segrega sustancias que actúan sobre sí mismo. (Específicamente, ciertas células del páncreas secretan hormonas que actúan localmente, es decir, en otras células del páncreas). Así es como funciona:
(1) Recuerda que en la serie que hice sobre la digestión, el páncreas era un actor importante para ayudar a tu cuerpo a descomponer los alimentos para que puedas absorber todos esos excelentes nutrientes de tu tarta de queso con nueces y caramelo, chuletón alimentado con pasto y espárragos orgánicos. El páncreas, en sí mismo, no digiere nada. Lo que hace es secretar varias enzimas en el intestino delgado, y es el intestino delgado el que realmente hace el trabajo de digestión. Las enzimas digestivas pancreáticas (que incluyen enzimas que descomponen proteínas, carbohidratos y grasas) llegan al intestino a través del conducto pancreático. Ésta es la función exocrina del páncreas.
(2) Las células beta especializadas del páncreas secretan insulina a la sangre y las células alfa secretan glucagón a la sangre. Esta es la función endocrina.
(3) La insulina y el glucagón viajan a través del torrente sanguíneo para ejercer sus efectos sobre las células diana en todo el cuerpo, pero también actúan localmente, en el páncreas mismo. Esta es la función paracrina. Este es un gran problema. Más grande que grande. Es enorme, de hecho, y ni siquiera me di cuenta de cuán grande era hasta hace unas dos semanas. Más sobre esto al final de la publicación.
La función digestiva/exocrina no es relevante para el tema en cuestión, por lo que la dejaremos de lado. Veamos la función endocrina. Cuando una persona sana que no sufre un desorden metabólico consume carbohidratos, su glucosa en sangre aumenta un poco y se secreta insulina para reducirla. Por otro lado, si ha pasado un tiempo desde que esta persona ha comido algo, el páncreas segrega glucagón. Recuerda el cuadro de hormonas anterior en donde el glucagón mantiene los niveles de glucosa en sangre durante el ayuno o, en realidad, solo entre las comidas, después de que la insulina ha vuelto a su nivel inicial bajo. El glucagón es lo que evita que la glucosa en sangre caiga en picada a niveles peligrosamente bajos si han pasado, por ejemplo, 14 horas desde su última comida.
Glucagón: Totalmente subestimado
El glucagón es una hormona fascinante. Es el Rodney Dangerfield de las hormonas: no lo respetan. Y eso es una pena. La verdad es que el glucagón juega un papel tan importante en todo esto que, al saber más sobre él, me preocupó haberles hecho un flaco favor a todos, porque debería haber llamado a esta serie «Es el glucagón, estúpido». Pero luego, cuando aprendí aún más, me sentí tranquila, porque realmente se trata de la insulina. (Cállate, Amy. A nadie le importa. Vuelve al tema).

Una de las cosas que estimula el glucagón es el nivel bajo de azúcar en sangre. Así es como el glucagón ayuda a mantener las cosas en equilibrio. No es necesariamente la glucemia «baja» lo que la estimula, es decir, no es que si tu glucemia alcanza los 35 mg/dl y, de repente, un gran aumento de glucagón la vuelve a subir. Digamos que es la caída de glucosa en sangre lo que le dice al glucagón que mantenga las cosas a salvo. Supongamos que tu glucemia está en un agradable y fresco 78. Bueno, tu cuerpo y tu cerebro están usando glucosa constantemente. Incluso con una dieta cetogénica, el cuerpo y el cerebro necesitan algo de glucosa. (Recuerda la publicación en donde se mencionó que hay algunas células, como los glóbulos rojos, que no tienen mitocondrias y, por lo tanto, no pueden metabolizar las grasas, deben usar glucosa. E incluso nuestras queridas cetonas no pueden proporcionar el 100% del combustible del cerebro). Con las células sacando glucosa del torrente sanguíneo todo el tiempo, si no hubiera un mecanismo para devolver algo de glucosa al torrente sanguíneo, te desmayarías y morirías rápidamente. Entonces, lo que hace el glucagón es realizar una especie de acto de equilibrio con la glucosa en sangre, asegurándose de que nunca baje demasiado.

Insulina, glucagón y glucosa en sangre: el último acto de equilibrio.
Otra cosa que estimula el glucagón es la ingesta de proteínas. Aquí es donde las cosas se ponen interesantes. los expertos en alimentación baja en carbohidratos saben que las proteínas estimulan la insulina. (Esto es algo bueno, y es gran parte del cómo construimos masa muscular; la insulina ayuda a escoltar los aminoácidos hacia las células. También es la razón por la que no necesitas carbohidratos después del entrenamiento. La proteína aumentará la insulina por sí sola). Algunos de ustedes, que no están tan familiarizados con los pros y contras de todo esto, pueden haber escuchado en alguna parte que las proteínas «aumentan la glucosa en sangre». Es posible que también hayas escuchado a personas decir que, en términos de regulación de la glucosa en sangre, para algunos, consumir demasiadas proteínas es tan malo como un pastel de chocolate, y por eso, las personas que siguen dietas bajas en carbohidratos con el propósito específico de mantener el azúcar en sangre bajo deben tener cuidado de no consumir proteínas en exceso.
No estoy argumentando que la ingesta de proteínas no aumente la glucosa en sangre – Lo hace. Ni tampoco que ciertos aminoácidos no sean muy glucogénicos – Lo son. PERO: veamos cómo funciona esto realmente, porque el bistec y el pollo no son pastel de chocolate, ¿de acuerdo?
Veamos esto a través de nuestra lente evolutiva. Digamos que tu tribu acaba de tener una buena caza. Y que estás en algún lugar al medio de la jerarquía tribal. Tal vez los machos y hembras de mayor rango se ganan los primeros bocados, y comen los órganos, las entrañas y algunas de las otras piezas preciadas de la presa. Para cuando sea tu turno de cortar un trozo, con tu práctica herramienta de piedra, tal vez todo lo que quede sea un gran trozo de carne de músculo y uno relativamente magro. Pero no es 2015 en los EE. UU., no hay papa al horno, panecillo con mantequilla ni refrescos para acompañar tu carne, por lo que tu comida es carne y nada más. Mucha proteína, un poco de grasa y prácticamente cero carbohidratos.

Si comieras este trozo de carne y la proteína aumentara la insulina (como lo hace), no solo los aminoácidos pasarían del torrente sanguíneo a las células, sino que también irían acompañados de una gran cantidad de glucosa. Ahora, dado que eres una «persona» del Paleolítico, digamos que tu glucosa en sangre está rondando los 75. Pero ahora, gracias a tu trozo de carne, tienes un aumento de insulina en ausencia de carbohidratos en la dieta. Sin una hormona contrarreguladora, tu glucosa en sangre podría bajar demasiado. (Es decir, asumiendo que no eres abiertamente cetogénico, puedes tener lo que de otro modo se consideraría una glucemia increíblemente baja, pero sentirte completamente bien si tus cetonas fueran lo suficientemente altas). Así que, gracias a Dios, hay una hormona contrarreguladora en el glucagón. Perdón por esta pequeña digresión; simplemente pensé que, para algunos de los lectores legos, que tal vez no sepan todo esto, sería una buena manera de explicar por qué la proteína de la dieta estimula tanto la insulina como el glucagón. Es bastante ingenioso cómo la naturaleza actúa.
ENTONCES: No creo que sea correcto decir que comer una gran cantidad de proteínas «aumenta la glucosa en sangre». Creo que lo que hace es estimular el glucagón, que a su vez, aumenta la glucosa en sangre para contrarrestar el efecto hipoglucemiante de la insulina. Esto es totalmente normal y no hay problema alguno, PARA UNA PERSONA METABÓLICAMENTE SALUDABLE. (Y es por eso que muchas personas con bajo contenido de carbohidratos no necesitan limitar deliberadamente la ingesta de proteínas). Pero veamos qué sucede en una persona metabólicamente poco saludable, específicamente, alguien que es resistente a la insulina.
Podría ser el glucagón, estúpido!! pero en realidad, sigue siendo la insulina
La resistencia a la insulina ocurre cuando las células ya no responden a la presencia de insulina. Sabemos con certeza que las células musculares pueden volverse resistentes a la insulina. Pero ¿sabes qué otros tipos de células pueden volverse resistentes a la insulina? LAS CÉLULAS ALFA DEL PÁNCREAS QUE SECRETAN GLUCAGÓN. ¡Sí! Ahora estamos llegando a alguna parte.
Es hora de examinar la función paracrina del páncreas. Recuerda la tabla de hormonas más arriba en donde el glucagón moviliza combustibles. Activa la gluconeogénesis, la glucogenólisis y la lipólisis. Sabemos que el glucagón hace esto. Así es como mantiene la glucosa en sangre a un nivel seguro (es decir, lo suficientemente alto) entre comidas o durante un ayuno más prolongado: cataboliza el tejido muscular existente para obtener algunos aminoácidos glucogénicos y estimula la descomposición del glucógeno en moléculas de glucosa individuales. También estimula la lipólisis, es decir, la descomposición de la grasa corporal almacenada, cuya porción de glicerol se puede utilizar para producir glucosa. Ahora que vemos lo que hace el glucagón, podemos comprender mucho mejor la diabetes tipo 1. La diabetes Tipo 1 es el glucagón enloquecido en ausencia (o deficiencia) de insulina. Sin tratamiento, los diabéticos tipo 1 permanecen en un estado perpetuo de catabolizar sus propios cuerpos para alimentarse. Rompen sus músculos, descomponen su tejido adiposo y, eventualmente, descomponen sus órganos. Puedes ver por qué, en ausencia de insulina para contrarrestar el glucagón, los diabéticos T1 pueden estar demacrados.
Aquí hay algo absolutamente fascinante sobre el páncreas paracrino. Antes de entrar en la circulación sanguínea general, la insulina secretada por las células beta actúa directamente sobre las células alfa. Las células alfa son la primera parada de la insulina antes de viajar al resto del cuerpo. Básicamente, la insulina le dice a las células alfa que dejen de producir glucagón. PERO: la cantidad o concentración de insulina que llega a las células alfa es mucho, mucho mayor que la concentración de insulina a la que responde el resto del cuerpo. Es casi como, al comprimirse las células alfa, la mayor parte de la insulina se desvía, por lo que queda una concentración mucho menor para el resto del cuerpo. Esto es lo que se supone que debe suceder. Y esto explica por qué es tan difícil para los diabéticos tipo 1 controlar su nivel de azúcar en sangre. Si se inyectaran insulina con la concentración necesaria para suprimir el glucagón, abrumaría por completo al resto del cuerpo y ciertamente induciría una «baja» potencialmente mortal. En el mejor de los casos, la cantidad de insulina que inyectan corresponde con la cantidad de carbohidratos (y proteínas) que ingieren. Pero esto no considera en absoluto la cantidad tan concentrada que necesitan las células alfa para dejar de secretar glucagón. Por eso es por lo que los DT1 tienen GS que está en todo el mapa.
Bien, de vuelta al mensaje. En una persona sana, los efectos catabólicos del glucagón solo dominan cuando la insulina es baja, entre comidas y durante un ayuno. Para alguien con una dieta baja en carbohidratos, el glucagón estará algo activo todo el tiempo, pero en el estado de alimentación, será mayormente anulado por la presencia de insulina; sí, incluso las cantidades relativamente pequeñas de insulina que una persona con bajo contenido de carbohidratos lo haría secretar. En un diabético tipo 1, el glucagón domina todo el tiempo. Esta es la razón por la que se consumen sin insulina exógena y también por la que tienen niveles altos de glucosa y cetonas simultáneamente. En una persona metabólicamente sana, incluso pequeñas cantidades de insulina son suficientes para limitar los efectos del glucagón. (Esta es la belleza de una dieta baja en carbohidratos en una persona sana: glucemia que no es ni demasiado alta ni demasiado baja. Vuelvo a enfatizar: la insulina no es tóxica. La insulina es excelente, siempre que su cuerpo sepa qué hacer con ella).
Dije anteriormente que la diabetes Tipo 1 es glucagón enloquecido, porque no hay insulina para apagar esa señal. Curiosamente, para muchos diabéticos tipo 2, su condición también es glucagón enloquecido, pero obviamente no es porque no haya insulina, hay una tonelada y a muchas células ya no les importa. Y recuerda: entre las células a las que ya no les importa están las células alfa productoras de glucagón. Debido a que las células alfa son resistentes a la insulina, funcionan como si no hubiera insulina. Es decir, continúan con la hemorragia de glucagón. Por lo tanto, incluso cuando la glucosa en sangre es alta, como después de una comida rica en carbohidratos, el glucagón puede aumentarla aún más. Los carbohidratos habrían aumentado la glucemia y, por lo tanto, la insulina; pero debido a que las células alfa ya no detectan la insulina allí, continuarán bombeando glucagón como si no se hubiera ingerido una comida rica en carbohidratos. ¿Y qué hará este glucagón, continuará elevando la glucemia aún más, al descomponer el tejido muscular existente para llegar a los aminoácidos glucogénicos? (Recuerde, sin embargo, que incluso con niveles elevados de glucosa, es posible que los diabéticos T2 hiperinsulinémicos no generen muchas cetonas, porque, en un cruel giro del destino, el tejido adiposo todavía parece ser sensible a la insulina y la insulina inhibe la lipólisis).

¿Esto es tan malo como la soda? ¡Vamos!.
Sospecho que esta es la razón por la que algunos diabéticos T2 a veces tienen glucemia entre 300 y 400, a pesar de (¿debido a?) estar usando insulina. Los cuerpos de estas personas producen glucosa casi sin importar lo que coman. Si no proviene de bagels y pasta, entonces sí, en una persona severamente resistente a la insulina, puede provenir de su propio tejido muscular, como un efecto posterior de la liberación incontrolada de glucagón. Sigo pensando que es engañoso decir que una chuleta de cerdo no es mejor, metabólicamente hablando, que una rosquilla de mermelada glaseada con azúcar. Pero puedes ver la lógica en esa afirmación, en el caso específico de las personas severamente resistentes a la insulina. Y puedes ver por qué a algunas de estas personas les va mejor con dietas que son muy bajas en carbohidratos y también relativamente bajas en proteínas, por ejemplo, tal vez 75% de grasa, 15% de proteína y 10% de carbohidratos. Mira, no solo necesitan controlar su consumo de carbohidratos; también deben ser conscientes de no estimular una tonelada de glucagón … al menos, no hasta que se vuelvan más sensibles a la insulina.
Y recuerde: la proteína eleva tanto la insulina como el glucagón. ESTA es la razón por la que las personas que son extremadamente resistentes a la insulina están mejor preparadas para no “consumir en exceso” proteínas. (Lo que sea que eso signifique, de todos modos. El umbral es una cosa individual). Si están comiendo «demasiado» de un alimento que aumenta el glucagón y, por extensión, la glucosa en sangre, pero no pueden eliminar esa glucosa de la sangre debido a resistencia a la insulina, esto es una especie de doble golpe.
Sospecho que estas fuerzas actuaban en mi propia madre, que tenía mal control de la diabetes tipo 2. Usaba insulina y su nivel de azúcar en sangre era completamente impredecible, independientemente de lo que comiera o de su dosis de insulina.
Es interesante notar que muchos diabéticos T2 con sobrepeso son «grandes», pero no parecen tener mucha masa muscular. Con lo que acabamos de cubrir, podemos especular que tal vez tengan menos músculos porque sus cuerpos son muy buenos para descomponerlos. En cuanto a cómo terminan pesando más, cuando alguien es muy resistente a la insulina (y recuerde, esto se aplica a sus células alfa), sospecho que funciona así:
Glucagón elevado -> cataboliza el músculo (lo destruye)
Insulina elevada -> NO cataboliza la grasa corporal almacenada
Vaya, ese es un escenario horrible en el que uno se encuentra a sí mismo: Romper su tejido muscular extremadamente valioso, pero no, ¡No toca nada de esa grasa! ¡La deja justo donde está! De hecho, ¡Produce más!
Bien, dado que finalmente, volví al tema de la grasa corporal, este es un buen lugar para terminar por ahora y comenzaremos de nuevo aquí la próxima vez.
Mientras tanto, si deseas más información sobre todas estas cosas del glucagón, puedo recomendar este video. No estaba bromeando cuando dije que yo misma acababa de aprender mucho de esto. La mayor parte provino directamente de este video. (Gracias de nuevo a Ivor Cummins por informarnos al resto de nosotros). No me avergüenza admitir que estaba absolutamente FASCINADA. Remachada. Esta fue mi reacción:
“Me VOLVÍ LOCA al ver unas 15 veces este video: insulina & glucagón.
Deben, deben *DEBEN* VERLO!!
A ti también te dejarán loca. Garantizado. (Especialmente cuando el Dr. Unger habla sobre la concentración de insulina cuando ejerce su función paracrina en las células alfa. En serio, ¡MÍRALO!)

